
Vector sử dụng để thêm gen
Phần lớn các vector sử dụng hiện nay để tạo động vật chuyển gen bằng cách thêm gen được xây dựng để được hợp nhất vào genome. Các phương pháp đang được sử dụng hoặc nghiên cứu để tăng tần số hợp nhất của gen ngoại lai hoặc duy trì chúng như là các nhiễm sắc thể nhỏ độc lập.
Vector thẳng tối thiểu (Minimum linear vectors)
Ở đại đa số trường hợp, các nhà nghiên cứu sử dụng các đoạn genome chứa một hoặc hai gen hay chuẩn bị các cấu trúc gen hoạt động chức năng từ các yếu tố khác nhau. Các đoạn của vector chứa các vùng phiên mã và điều hòa từ plasmid. Thực vậy, các vector vòng hợp nhất với tần số thấp hơn nhiều so với các đoạn DNA thẳng và trình tự plasmid thường phá hủy các gen chuyển đã liên kết. Ðiều này đúng đối với các vector khác nhau như plasmid, cosmid, phage, BAC và YAC. Tuy nhiên một số nghiên cứu cho thấy rằng vector BAC vòng hợp nhất vào genome với hiệu quả giống như bản sao mạch thẳng của chúng. Nói cách khác, các vector mang các đoạn
 |
| Tạo dòng bằng vector plasmid |
DNA genome dài ít nhạy với hiệu quả câm của các trình tự của prokaryote. Ðiều này là thích hợp nhất nhờ sự hiện diện của các yếu tố cách ly ở các đoạn genome dài hoặc nhờ một hiệu quả khoảng cách đơn giản.
Các đoạn DNA không chứa các trình tự đặc biệt hợp nhất vào genome với tần số tương đối thấp. Một số DNA xen vào tạo ra số động vật chuyển gen nhiều hơn so với các DNA khác. Ðiều này có thể xuất hiện từ sự có mặt của các trình tự trong đoạn xen mà nhận biết thường xuyên các trình tự genome (Hình 1). Một số các đoạn xen vào có thể chứa các trình tự ưu tiên cho sự phiên mã của chúng và sự duy trì của chúng trong phôi, tăng cường sự hợp nhất xảy ra.
Vector chứa các trình tự lặp lại
Cơ chế của sự hợp nhất được mô tả ở hình 1 bao hàm sự nhận biết giữa các trình tự của đoạn xen và của genome. Tần số của sự hợp nhất được tăng lên nhờ sự có mặt ở cả hai đầu của các đoạn xen các trình tự lặp lại cao trong genome chủ ngay cả khi chúng bị thoái hóa nhiều hoặc ít. Ở bò, một trình tự có mặt nhiều ở tâm động làm tăng thêm các đoạn xen đã tăng tần số hợp nhất. Ở trường hợp đặc biệt này, các gen chuyển vẫn không hoạt động. Ðiều này là do tâm động là vùng không phiên mã của genome phá hủy gen chuyển.
Một phương pháp tương tự đã được tiến hành ở chuột, sử dụng các trình tự Alu. Các trình tự này là các yếu tố lặp lại. Các trình tự Alu chứa 200-300 nucleotid là có nhiều trong genome động vật có vú và đặc biệt là ở các vùng lân cận hoặc ở trong các vùng phiên mã. Một số trình tự Alu được phiên mã bởi RNA polymerase III, làm cho chức năng của RNA không rõ ràng và có thể không tồn tại. Các thí nghiệm đã cho thấy rằng tần số hợp nhất được tăng lên đối với các đoạn xen chứa trình tự Alu.
Vector transposon
Transposonlà một đoạn DNA có khả năng tự tái bản một cách độc lập và xen vào một vị trí mới trong cùng nhiễm sắc thể hoặc một nhiễm sắc thể khác (Hình 1.2). Với tiến bộ của kỹ thuật di truyền transposonđã được sửa đổi, thiết kế thành các công cụ di truyền với mục đích đặc biệt.
 |
| Cấu trúc của transposon |
Kích thước của transposon nói chung là không dài hơn 2kb. Nhiều bản sao của transposon có mặt trong genome tại các vị trí ngẫu nhiên một cách rõ ràng. Transposon được phiên mã thành RNA, RNA được phiên mã ngược thành DNA sợi kép. DNA sợi kép này hợp nhất vào genome với hiệu quả cao. Sự hợp nhất được điều khiển bởi gen transposase mã hóa transposon và các trình tự lặp lại đảo ngược ITR (inverted repeated sequence). Các trình tự lặp lại đảo ngược có mặt ở cả hai đầu của transposon (Hình 3). Cơ chế này cho phép transposon trải rộng ra một cách nhanh chóng và tỏa khắp genome, bao gồm cả sự bất hoạt gen trong một số trường hợp. Sự lan tỏa của transposon bị giới hạn bởi cơ chế tế bào làm bất hoạt sự phiên mã của transposon.
Transposon là vector có tiềm năng đối với sự hợp nhất gen ngoại lai vào genome. Ðể làm được điều này, một phần lớn vùng phiên mã của transposon bị mất đi, tạo ra khoảng trống đối với gen ngoại lai và ngăn cản transposon trải rộng một cách tự chủ và không kiểm soát trong genome.
DNA tái tổ hợp chứa gen ngoại lai không có khả năng đặc biệt để tự hợp nhất vào genome. Sự có mặt của gen transposase là cần thiết đối với mục đích này. Tiêm đồng thời transposon mang gen ngoại lai và plasmid vòng có khả năng biểu hiện gen transposase cho phép transposon hợp nhất với hiệu quả có ý nghĩa, khoảng 1-5 % số phôi được tiêm (Hình 3).
Protocol này được áp dụng trước tiên cho Drosophila, sử dụng transposon P và sau đó đã được sử dụng rộng rãi để tạo sinh vật chuyển gen (Kayser, 1997). Transposon thủy thủ (mariner) đã tỏ ra có hiệu quả đối với tế bào cá medaka, gà và động vật có vú. Các sửa đổi khác nhau của transposon này làm cho nó có thể mang một vector hiệu quả và an toàn đối với liệu pháp gen (Hackett, 2001).
Các vector khác được sử dụng để tạo côn trùng chuyển gen như Aedes aegypti hoặc tằm (Tamura, 1999). Gần đây transposon đã được sử dụng để tạo chuột chuyển gen (Dupuy, 2002).
 |
| Sử dụng vector transposon để chuyển DNA ngoại lai |
Gen transposase được thay thế bằng gen mong muốn. Transposon tái tổ hợp được tiêm vào tế bào. Vector điều khiển sự tổng hợp enzyme gắn (intergrase) được cùng tiêm vào. Transposon được hợp nhất bằng cách sử dụng các trình tự lặp lại đảo ngược ITR của chúng
Trong tất cả các trường hợp, transposon và plasmid mã hóa cho transposase phải được tiêm vào tế bào chất của phôi dưới các điều kiện khác nhau tùy thuộc từng loài. Về phương diện này, gà là khác với hầu hết các loài khác. Việc tiêm gen có thể được thực hiện ở giai đoạn phôi một tế bào mà không thể đưa trở lại vào con mẹ nuôi dưỡng như trường hợp đối với thú. Phôi tiêm gen phải được đưa vào noãn hoàng của một trứng không mang phôi. Sau vài tuần ấp trứng dưới các điều kiện được kiểm soát tốt, gà chuyển gen được sinh ra với một tỉ lệ thành công có thể chấp nhận (Shermann, 1998).
Vì vậy, vector transposon cho phép tạo ra các động vật chuyển gen đối với các loài mà vi tiêm DNA thông thường không thành công. Vector này cũng được xem là an toàn. Vector transposon thủy thủ ngay cả khi thiếu gen transsposae của nó cũng có thể tái bản và hợp nhất vào genome chủ với tần số thấp. Ðiều này là do sự có mặt của transposase nội sinh của tế bào chủ. Vấn đề này có thể giới hạn sự sử dụng transposon trong một số trường hợp. Trong khi đó, transposon BAC lợn con đã được sử dụng để tạo ra tằm chuyển gen ổn định hoàn toàn sau một số thế hệ.
Transposon chỉ có thể mang các đoạn DNA ngoại lai với chiều dài giới hạn. Các cấu trúc phức tạp được sử dụng để biểu hiện gen ngoại lai rõ ràng cũng là một hạn chế. Ngoài ra các cơ chế tế bào phá hủy transposon có thể ức chế sự biểu hiện của gen chuyển trong một số trường hợp.
Vector retrovirus
Cấu trúc của retrovirus
Retrovirus là loại virus RNA, có vỏ bọc bên ngoài. Sau khi xâm nhiễm, genome virus được sao chép ngược thành DNA sợi kép, hợp nhất vào genome tế bào chủ và biểu hiện thành protein.
Retrovirus đặc trưng bởi chu kỳ tái bản của chúng, được mô tả lần đầu tiên vào đầu thập niên 1900 (Ellermann và Bang.O, 1908).
Hạt retrovirus có kích thước, hình dạng có thể thay đổi đôi chút nhưng đường kính khoảng 100nm. Vỏ của virus là glycoprotein, tạo thành các gai ở màng (Hình 1.4A). Protein trưởng thành này được chia làm hai loại polypeptid (Hình 1.4B):
- Glycoprotein vỏ bên ngoài (SU), kháng nguyên chủ yếu của virus, có chức năng bám vào thụ quan.
- Glycoprotein màng (TM), bám vào protein SU ở vỏ, chịu trách nhiệm đối với sự dung hợp màng.
 |
| Sơ đồ cấu trúc cắt ngang của retrovirus |
Bên trong màng là protein cơ bản (MA), không định hình. Protein này bao lấy capsid (CA). CA là protein phong phú nhất trong hạt virus (chiếm khoảng 33 % trọng lượng tổng số), có hình khối 20 mặt. Bên trong capsid là lõi, thường có hình nón, bao gồm: RNA genome, protein nucleocapsid (NC), enzym phiên mã ngược (reverse transcriptase = RT) và enzyme hợp nhất (intergrase = IN).
Genome retrovirus bao gồm hai bản sao của phân tử RNA sợi đơn, mạch thẳng, có cap ở đầu 5’ và đuôi poly A ở đầu 3’ (tương đương với mRNA). Genome retrovirus có kích thước khoảng 8-11kb.
Retrovirus được chia làm hai loại là retrovirus đơn giản và retrovirus phức tạp.
RNA của retrovirus đơn giản chứa 3 nhóm gen chủ yếu:
- Gen gas mã hóa protein lõi, capsid và nucleoprotein.
- Gen pol mã hóa enzyme phiên mã ngược và enzyme hợp nhất.
- Gen env mã hóa protein trong cấu trúc vỏ của virus.
Trật tự của các nhóm gen này ở tất cả các retrovirus là không thay đổi:
5’ – gag – pol – env – 3’
Ngoài ra còn có nhóm gen pro mã hóa enzyme protease viruss. Các retrovirus đơn giản bao gồm hầu hết các virus gây ung thư như viruss bạch cầu chuột Moloney Mo-MLV (Moloney, 1960), virus ung thư tuyến vú chuột (mouse mammary tumor virus = MMTV) (Bittner, 1936 ).
Các retrovirus phức tạp, ngoài ba nhóm gen chủ yếu gag, pol và env còn có các gen khác như tat, rev ở HIV-1. Nhóm virus này bao gồm các lentivirus kể cả virus HIV-1, spumavirus, HFV (human foamy virus) và SFV (simian foamy virus).
Ở mỗi đầu của genome là các đoạn lặp dài tận cùng (LTR) chứa tất cả các tín hiệu cần thiết cho sự biểu hiện gen của virus. Một đoạn LTR gồm có 3 vùng: U3, R và U5. Vùng U3 bao gồm các yếu tố kiểm soát sự phiên mã, promoter và gen tăng cường (enhancer). Ðây là vùng không mã hóa có kích thước 75-250 nucleotid, là phần đầu tiên của genome được phiên mã ngược, tạo ra đầu 3’ của genome provirus. Vùng R thường là trình tự có kích thước ngắn chỉ khoảng 18-250 nucleotid tạo thành đoạn lặp trực tiếp ở cả hai đầu của genome. Vùng U5 là vùng không mã hóa có kích thước 200-1.200 nucleotid tạo nên đầu 5’ của provirus sau khi phiên mã ngược. vùng U5 mang vị trí poly A và cùng với vùng R xác định sự gắn thêm đuôi poly A vào. Cả hai vùng U3 và U5 đều mang vị trí gắn att cần thiết cho sự hợp nhất genome của virus vào genome chủ.
Mặt khác, genome virus còn có đoạn dẫn đầu (leader), vị trí bám primer (primer binding site = PBS) và vùng polypurine (polypurine tract = PPT). Ðoạn dẫn đầu không được dịch mã, khá dài, có kích thước khoảng 90-500 nucleotid, xuôi theo vị trí khởi đầu phiên mã, nằm giữa vùng U3 và R, ở phía đầu 5’ của tất cả các virus mRNA. PBT dài 18 nucleotid bổ sung với đầu 3’ của primer tRNA đặc hiệu được virus sử dụng để bắt đầu phiên mã ngược. PTT ngắn chỉ khoảng 10 A hoặc G có chức năng khởi đầu sự tổng hợp sợi (+) trong quá trình phiên mã ngược.
 |
| Sơ đồ cấu trúc genome của retrovirus |
Ngoài ra còn có các trình tự cần thiết cho sự đóng gói genome virus gọi là trình tự Ψ (psi) và các vị trí cắt RNA ở gen env.
Một số retrovirus chứa protooncogene. Khi protooncogene bị đột biến có thể gây ra ung thư.
Vector retrovirus
Vector retrovirus là cấu trúc DNA nhân tạo có nguồn gốc từ retrovirus, được sử dụng để xen DNA ngoại lai vào nhiễm sắc thể của vật chủ.
Yếu tố chìa khóa trong việc sử dụng retrovirus làm thể truyền phân phối gen là sự an toàn sinh học (biosafety). Mục đích chính của thiết kế vector là bảo đảm tạo ra một virus không khả năng tái bản (replication incompetent virus) trong tế bào chủ (Hình 6 ).
 |
| Virus nguyên vẹn có khả năng tái bản và vector retrovirus không có khả năng tái bản |
Về nguyên tắc, có thể tạo ra vector retrovirus có khả năng tái bản (replication competent retroviral vector) bằng cách thêm các trình tự cần thiết vào virus (Hình 1.6). Nhưng một thiết kế phổ biến hơn là thay thế các gen của virus bằng các gen chuyển mong muốn để tạo ra vector tái bản không hoàn toàn (replication defective vector). Mặt khác, kích thước của đoạn DNA ngoại lai mà vector tái bản không hoàn toàn có thể tiếp nhận lớn hơn nhiều so với vector có khả năng tái bản. Sự biểu hiện của các protein retrovirus ở hầu hết các retrovirus gây ung thư xảy ra tự nhiên do một promoter đơn (single promoter) nằm trong đoạn lặp dài tận cùng (LTR) ở đầu 5’và sự biểu hiện của các vùng mã hóa virus phức tạp xảy ra nhờ sự cắt ghép xen kẻ (alternative splicing). Tuy nhiên, việc thiết kế vector là không bị giới hạn do sử dụng promoter retrovirus đơn. Một hướng thiết kế khác là sử dụng promoter phức (multiple promoter) và các trình tự tiếp nhận ribosome ở bên trong (internal ribosome entry site = IRES).
Sự tải nạp và hợp nhất gen có hiệu quả phụ thuộc vào các yếu tố virus có mặt trong vector retrovirus.
Một điểm lưu ý quan trọng khi thiết kế vector retrovirus là hiệu quả tái bản của virus trong cấu trúc vector.
Phần lớn các vector retrovirus thường được thiết kế dựa trên virus Mo-MLV. Ðây là loại virus có khả năng xâm nhiễm vào cả các tế bào chuột (có thể phát triển vector ở mô hình chuột) và tế bào người (có thể điều trị bệnh cho người). Các gen của virus (gag, pol và env) được thay thế bằng các gen chuyển mong muốn và được biểu hiện ở các plasmid trong dòng tế bào đóng gói. Các vùng cần thiết bao gồm các đoạn lặp dài tận cùng ở đầu 3’ và 5’ (3’LTR và 5’LTR) và trình tự đóng gói.
Trước đây virus hỗ trợ khả năng tái bản đã được sử dụng để đóng gói cả virus vector và virus hỗ trợ. Trong một phương pháp tinh vi hơn được sử dụng hiện nay, các dòng tế bào đã thao tác di truyền đặc hiệu đã biểu hiện các gem virus do các promoter không tương đồng được sử dụng để tạo ra các virus vector. Các dòng tế bào này được gọi là các dòng tế bào đóng gói hoặc các dòng tế bào hỗ trợ.
Chuyển gen và biểu hiện gen bằng một vector virus được gọi là sự tải nạp để phân biệt với quá trình xâm nhiễm của retrovirus có khả năng tái bản (replication competent retrovirus = RCR).
Sự biểu hiện của gen chuyển là do promoter hoặc gen tăng cường ở vị trí 5’ LTR hoặc bởi các promoter virus (như cytomegalovirus, Rous sarcoma virus) hoặc bởi các promoter của tế bào (như beta actin, tyrosine). Sự định vị chính xác codon khởi đầu của gen chuyển và các thay đổi nhỏ của 5’LTR ảnh hưởng đến sự biểu hiện của gen chuyển (Rivire,1995).
 |
| Quá trình đóng gói tạo hạt retrovirus |
 |
| Cơ chế hoạt động của vector retrovirus |
Ðể nhận biết các tế bào biến nạp, các marker chọn lọc như neomycin và beta galactosidase được sử dụng và sự biểu hiện của gen chuyển có thể được cải tiến bằng cách thêm vào các trình tự ribosome bên trong (Saleh, 1997).
Một yêu cầu đối với sự hợp nhất và biểu hiện của các gen virus là các tế bào đích phải phân chia. Ðiều này giới hạn liệu pháp gen tăng sinh tế bào in vivo và ex vivo, do đó các tế bào thu nhận từ cơ thể được xử lý để kích thích tái bản và sau đó được tải nạp với retrovirus trước khi đưa trở lại bệnh nhân.
Ứng dụng của vector retrovirus
Vector retrovirus là cần thiết cho liệu pháp gen, đã được sử dụng có hiệu quả trong nhiều liệu pháp gen chữa bệnh cho người như suy giảm miễn dịch do thiếu hụt enzyme ADA, ung thư, tiểu đường, thiếu máu,...
Các vector retrovirus khác nhau đã được thiết kế để tạo động vật chuyển gen và gà chuyển gen đặc biệt (Ronfort, Legras và Verdier, 1997). Các vector này mang các trình tự env có khả năng nhận biết các tế bào phôi gà. Chúng được tiêm vào trứng gà mới đẻ. Ở giai đoạn này, các tế bào hãy còn đa năng và có thể tham gia vào việc tạo thành giao tử, dẫn đến truyền gen ngoại lai cho thế hệ sau. Phương pháp này cho hiệu quả không cao. Phôi ở giai đoạn này chứa khoảng 60.000 tế bào. Chỉ một tỉ lệ nhỏ các tế bào này có cơ hội mang gen chuyển nhờ vector retrovirus. Gà chuyển gen tạo thành ở dạng thể khảm và có rất ít cơ hội truyền gen chuyển của chúng cho thế hệ sau. Một phương pháp khác đã chứng tỏ có hiệu quả hơn. Việc tiêm gen được thực hiện ở giai đoạn phôi 16 tế bào tại vùng lân cận của các tế bào gốc nguyên thủy. Các tế bào này được tiêm một cách ưu tiên, tạo ra các động vật chuyển gen có cơ hội truyền gen chuyển của chúng cho thế hệ sau (Hình 9).
Vector retrovirus cũng được sử dụng để chuyển gen vào noãn bào của bò và khỉ (Chen, 1998, 2001). Ðể tiến hành công việc này đòi hỏi hai điều kiện đặc biệt. Vỏ của vector là protein G của VSV (vesicular somatitis virus) có chức năng nhận biết màng phospholipid và vì vậy cho phép tiêm vào nhiều loại tế bào khác nhau. Các hạt virus được tiêm vào giữa màng trong (zona pellucida) và màng noãn bào vào lúc màng nhân đã biến mất, tạo cho genome virus cơ hội tốt nhất để có thể đến được genome tế bào chủ (Hình 9).
Lentivirus là một phân lớp của retrovirus. Chúng có khả năng hợp nhất vào genome của các tế bào ở pha nghỉ, cả các tế bào tăng sinh và tế bào không tăng sinh. Khả năng này có được là do sự có mặt của một tín hiệu ở một trong số các protein virus. Protein virus này nhắm tới genome của virus ở vùng nhân. Lentivirus phức tạp hơn các retrovirus đơn giản, chứa thêm 6 gen tat, rev, vpr, vpu, nef và vif. HIV là một loại lentivirus. Vector lentivirus được nghiên cứu nhiều do tiềm năng sử dụng của chúng trong liệu pháp gen.
 |
| Sử dụng vector retrovirus để tạo động vật chuyển gen |
Genome virus mang gen ngoại lai được đưa vào tế bào tổng hợp protein virus khuyết. Các hạt virus được sử dụng để tiêm vào noãn bào động vật có vú (bò, khỉ), các tế bào mầm nguyên thủy của gà hoặc phôi một tế bào của chuột.
Một nghiên cứu gần đây cho thấy rằng vector lentivirus tiêm vào phôi một tế bào hoặc ủ với phôi đã được loại bỏ màng trong là có hiệu quả đặc biệt đối với việc chuyển gen vào chuột (Lois, 2003). Các vector này ngày càng được cải tiến tinh vi hơn. Genome của chúng có nguồn gốc từ lentivirus đã tạo ra các hạt virus tái tổ hợp có khả năng nhiễm vào tế bào phân chia hoặc tế bào không phân chia. Vector này chứa LTR đã được sửa đổi dẫn đến sự tự bất hoạt genome virus đã hợp nhất. Ðiều này làm giảm đáng kể khả năng tái tổ hợp tạo ra virus xâm nhiễm mang gen ngoại lai với phương thức không kiểm soát. Các loại vector này không có các gen tăng cường. Sự vắng mặt các gen tăng cường làm cho nó có thể thay thế cho một promoter nội sinh điều khiển gen mong muốn hoạt động mà không lệ thuộc vào ảnh hưởng của các gen tăng cường LTR. Vector này cũng chứa một yếu tố điều hòa sau phiên mã ưu tiên cho việc biểu hiện gen và một đoạn của virus HIV mà đoạn này cho phép genome virus đi vào nhân của tế bào không phân chia và hợp nhất vào DNA chủ.
Các vector này cũng có thể điều khiển sự biểu hiện gen FGFP của chuột, tạo ra màu xanh huỳnh quang ở tất cả các loại tế bào hoặc chỉ ở tế bào cơ khi promoter hoạt động ở tất cả các loại tế bào hoặc chỉ ở tế bào cơ.
Khoảng 80% chuột sinh ra là chuột đã được chuyển gen. Khoảng 90% số chuột này biểu hiện gen chuyển của chúng ở một số thế hệ. Protein VSV đã được sử dụng như là một vỏ bọc cho phép xâm nhiễm hiệu quả vào phôi.
Ưu điểm chính của vector này là hiệu quả biến nạp cao, thao tác đơn giản, sự xâm nhiễm có thể được thực hiện bằng cách ủ phôi đã loại bỏ màng trong với thể virus. Phương pháp này được mở rộng đối với các động vật có vú khác mà không có vấn đề đặc biệt. Phương pháp này thuận lợi một cách đặc biệt cho việc chuyển gen vào chuột trong khi phương pháp vi tiêm là rất khó sử dụng ở đây.
Hạn chế của vector này cũng không ít. Các hạt virus phải được kiểm soát an toàn sinh học bằng biện pháp thích hợp. Bước này ngày càng được tiêu chuẩn hóa nhằm tăng cường sử dụng các loại vector này cho liệu pháp gen. Các đoạn DNA có kích thước không vượt quá 7-9kb có thể được đưa vào vector này. Sự biểu hiện của gen reporter là tương đối thấp trong trường hợp này. Mặt khác, sự hợp nhất độc lập của vector xảy ra trong cùng một phôi dẫn đến động vật chuyển gen thể khảm.
Rõ ràng, phương pháp này chỉ có thể thay thế vi tiêm trong một số trường hợp.
Vector Adenovius
Cấu trúc của adenovirus
Adenovirus là loại virus không có vỏ, chứa genome DNA sợi kép, mạch thẳng. Trong khi có hơn 40 dòng adenovirus typ huyết thanh phần lớn gây nhiễm trùng đường hô hấp ở người thì chỉ có nhóm phụ C typ huyết thanh 2 hoặc 5 được sử dụng làm vector một cách ưu thế. Chu trình sống của adenovirus thường không liên quan đến sự hợp nhất vào genome vật chủ, chúng tái bản như các yếu tố episome trong nhân của tế bào chủ và vì vậy không có nguy cơ phát sinh đột biến xen (insertional mutagenesis).
Tất cả các hạt adenovirus đều không có vỏ, đường kính 60-90nm. Chúng có tính đối xứng icosahedron, dễ dàng nhìn thấy dưới kính hiển vi điện tử khi nhuộm âm tính. Vỏ capsid của adenovirus bao gồm 252 capssomer. Lõi của hạt virus chứa tối thiểu 4 protein: protein đầu mút (terminal protein = TP), gắn với đầu 5’ của genome bằng liên kết đồng hóa trị; protein V (180 bản sao/hạt virus) và protein VII (1070 bản sao/hạt virus), là các protein cơ bản và protein Mu, một protein nhỏ (4kD), vị trí và chức năng chưa được biết.
 |
| Adenovirus |
 |
| Sơ đồ cấu trúc cắt ngang của adenovirus |
Genome của adenovirus là phân tử DNA sợi kép không phân đoạn, dài 30-38kb (các nhóm khác nhau có kích thước khác nhau), có thể mã hóa 30-40gen. Có 4 vùng gen phiên mã sớm là E1, E2, E3 và E4, có chức năng điều hòa và một sản phẩm phiên mã muộn mã hóa cho các protein cấu trúc. Các trình tự ở đầu mút của mỗi sợi là lặp lại đảo ngược vì vậy các sợi đơn đã biến tính có thể tạo ra cấu trúc “cán xoong” (“panhandle”). Ngoài ra, còn có protein 55kD liên kết với đầu 5’ của mỗi sợi bằng liên kết đồng hóa trị.
Vector adenovirus
Vector adenovirus là vector chuyển gen được tạo ra từ các adenovirus tái tổ hợp.
Thế hệ adenovirus tái tổ hợp đầu tiên đã được thiết kế bằng cách loại bỏ gen E1. Sự loại bỏ gen E1 làm cho virus không có khả năng tái bản trong tế bào chủ. Gen E3 thường cũng được loại bỏ để dành chỗ cho gen chuyển. Phần genome mã hóa protein cấu trúc của virus được thay thế bằng một gen marker (như β-galactosidase) hoặc gen cDNA liệu pháp. Phần lớn các vector “cán xoong” được thiết kế gần đây chỉ chứa một trình tự lặp lại đảo ngược ITR và một trình tự đóng gói. Tất cả các gen cần thiết của virus được cung cấp bởi virus hỗ trợ.
Vector virus này không hợp nhất vào nhiễm sắc thể tế bào và nó tồn tại như một episome ở trong nhân.
Adenovirus là một vector chuyển gen an toàn, có thể xâm nhiễm một cách hiệu quả vào các tế bào không phân chia và các tế bào đang phân chia của nhiều loại tế bào khác nhau do các loại tế bào đích này chứa các thụ quan phù hợp với adenovirus. Khi xâm nhiễm vào tế bào chủ, phần lõi mang genome virus và gen ngoại lai đi qua lỗ màng nhân. Trong nhân tế bào chủ, các gen của adenovirus và gen ngoại lai sẽ phiên mã và dịch mã trong tế bào chất để tạo nên các loại protein cần thiết cho virus và protein mong muốn do gen ngoại lai mã hóa. Hạn chế của vector adenovirus thứ nhất là giảm khả năng sinh miễn dịch và vị trí ở ngoài nhiễm sắc thể của nó làm cho sự biểu hiện gen chỉ nhất thời, không bền. Kết quả của một số nghiên cứu đã cho thấy rằng sự biểu hiện gen chuyển chỉ kéo dài từ một vài ngày đến một vài tuần.
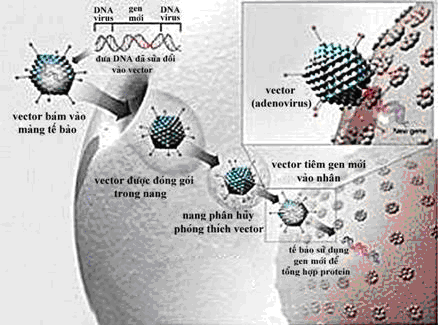 |
| Cơ chế hoạt động của vector adenovirus |
Ðể khắc phục những vấn đề nêu trên, các thế hệ adenovirus thứ hai và thứ ba đã được tạo ra. Trong các vector này, gen E4 (hoặc E2) mã hóa nhiều protein của virus được loại bỏ để giảm sự biểu hiện các protein virus.
Ứng dụng của vector adenovirus
Adenovirus người thế hệ thứ nhất đã được sử dụng rộng rãi làm vector chuyển gen in vivo (Wilson, 1996). Các vector này đã được sử dụng để chuyển gen người in vivo vào tế bào mũi, tế bào phổi (CFTR cDNA), tế bào màng trong mạch, tế bào thận (Heikkila, 1996; Sukhatme, 1997), tim, gan, hệ thần kinh trung ương, cơ, các tế bào mô máu và tế bào ung thư (Jaffe, 1992; Engelhardt, 1993; Chen, 1994; Chang, 1995; Cussack, 1996; Simon, 1999). Merrrich (1996) đã so sánh tính lây nhiễm của adenovirus tái tổ hợp typ 5 tái bản không hoàn toàn ở các tế bào màng trong mạch trong môi trường nuôi cấy in vitro. Kết quả cho thấy trong môi trường nuôi cấy, sự lây nhiễm là tốt ở cả tế bào màng trong mạch của người và lợn.
Vector episome
Lợi thế của quá trình hợp nhất khi sử dụng vector này là DNA ngoại lai được truyền một cách ổn định cho thế hệ sau. Hạn chế chính là sự hợp nhất hiếm xảy ra. Một vấn đề khác là gen đã hợp nhất bị phụ thuộc vào hoạt động của môi trường chromatin của nó, làm thay đổi thường xuyên sự biểu hiện của gen chuyển. Mặt khác, số lượng bản sao hợp nhất bị hạn chế, nói chung là không vượt quá 10 và trong một số trường hợp không phải tất cả các bản sao này được phiên mã có hiệu quả.
Người ta đang mong muốn loại bỏ phần lớn các hạn chế này khỏi vector episome. Genome episome đã được phát hiện trong một số cơ thể sống. Ðây là trường hợp đối với vi khuẩn chứa nhiều plasmid. Thỉnh thoảng các đoạn nhiễm sắc thể có nguồn gốc từ sự suy thoái cục bộ của nhiễm sắc thể được tìm thấy trong tế bào, đặc biệt trong một số tế bào khối u. Các đoạn nhiễm sắc thể này là các nhiễm sắc thể nhỏ (minute chromosome) được tái bản một cách độc lập và truyền lại cho các tế bào con. Các lớp virus khác nhau có genome tái bản một cách độc lập và truyền lại cho các tế bào con. Ðây là trường hợp đối với các virus họ herpes.
Genome episome phải chứa một số các yếu tố để được bền vững. Genome episome có dạng vòng hoặc dạng thẳng. Khi ở dạng vòng, thành phần nhỏ nhất của chúng là khởi điểm tái bản. Tại khởi điểm tái bản này sự tổng hợp DNA được bắt đầu như là một hệ thống làm cho nó có thể truyền genome tái bản đến các tế bào con. Genome episome dạng thẳng phải mang telomere ở cả hai đầu. Cấu trúc telomere này có mặt ở các đầu mút của các nhiễm sắc thể bình thường. Chúng thường xuyên bị suy thoái bởi exonuclease và được phục hồi lại nhờ một phức hợp enzyme đặc hiệu. Telomere bảo vệ nhiễm sắc thể khỏi bị suy thoái bởi exonuclease. Khi tế bào già hơn, sự tổng hợp telomere trở nên ít hiệu quả hơn dẫn đến suy thoái nhiễm sắc thể và sự chết của tế bào.
Các loại vector episome khác nhau có thể được thiết kế để tạo động vật chuyển gen. Chúng có kích thước tương đối nhỏ, chỉ mang các yếu tố tái bản và truyền lại cho các tế bào con. Một phương pháp khác bao gồm sự sử dụng các đoạn nhiễm sắc thể mang tất cả các yếu tố tự nhiên để chuyển gen cho thế hệ sau.
Các vector episome được biết rõ và sử dụng thường xuyên nhất là plasmid, cosmid, phage, BAC và YAC. Không có một loại vector nào có thể được sử dụng ở eukaryote bậc cao do các yếu tố của chúng không hoạt động trong các tế bào động vật. Các vector này được sử dụng chủ yếu là để xây dựng DNA và tạo DNA tái tổ hợp để nghiên cứu và chuyển vào tế bào động vật.
Các vector vi khuẩn chỉ chứa một khởi điểm tái bản. Số bản sao tạo ra sau khi tái bản DNA là đủ để cho phép truyền vector có tính thống kê đến các tế bào con.
Vector YAC dạng thẳng đã được thiết kế (Hình 13). YAC chứa các telomere, một khởi điểm tái bản (ARS 1), một tâm động (CEN 4), một gen chọn lọc (Ura 3) và các vị trí tạo dòng. Vector này tương đối ngắn và dễ thao tác. Sở dĩ như vậy là do khởi điểm tái bản và tâm động ngắn. Khởi điểm tái bản của nấm men Saccharomyces cerrevisae được tập trung trong một vùng genome ngắn trong khi ở Saccharomyces pombe khởi điểm tái bản dài đến trên vài nghìn base. Vector YAC có thể mang các đoạn DNA dài 1000kb và chúng có thể được thiết kế trong nấm men bằng tái tổ hợp tương đồng. Hạn chế chủ yếu của vector YAC là không ổn định (Giraldo và Montoliu, 2001).
 |
| Cấu trúc của vector YAC |
Vector này chứa một khởi điểm tái bản DNA (ARS 1), một tâm động (CEN 4) làm cho nó có thể phân chia vector tái bản về các tế bào con, telomere bảo vệ DNA khỏi bị suy thoái bởi exonuclease, hai gen chọn lọc (TRP 1 và UR 3) và một vị trí tạo dòng mà có thể đưa vào một đoạn có kích thước lên đến 1000kb
Vector BAC đã được thiết kế để tái bản trong E.coli và chỉ hiện diện một bản sao trong mỗi tế bào. Chúng có thể mang các đoạn DNA có kích thước lên đến 250kb. Chúng có thể được xây dựng trong vi khuẩn bằng tái tổ hợp tương đồng. Ðiều này cho phép cả việc đưa các đoạn DNA ngoại lai vào trong vector cũng như loại bỏ chúng đi. Vector BAC hiện là công cụ tốt nhất cho việc chuẩn bị các cấu trúc mang các đoạn DNA có kích thước lớn để dùng cho việc tạo động vật chuyển gen (Giraldo và Montoliu, 2001) (Hình 14).
 |
| Sơ đồ cấu trúc vector BAC |
Trong tế bào động vật, vẫn không thể tạo ra các vector ngắn mang các yếu tố tự nhiên đã tìm thấy trong nhiễm sắc thể. Khởi điểm tái bản ở genome động vật là các vùng xác định không tốt. Một số vùng đã được mô tả đặc điểm và được sử dụng để tái bản DNA trong tế bào nuôi cấy và trong chuột chuyển gen. Như thế đoạn DNA genome chứa vài nghìn bp là luôn được yêu cầu để khởi đầu một quá trình tái bản DNA. Một phương pháp khả thi là tạo dòng các đoạn DNA genome vào vector và chọn lọc các đoạn có khả năng tái bản cao nhất trong tế bào động vật. Thí nghiệm này đã cho thấy rằng tối thiểu một khởi điểm tái bản là có mặt trong một đoạn DNA động vật có kích thước khoảng 40kb (Kelleher, 1998).
Các khởi điểm tái bản là không thích hợp để cho một vector vòng được truyền một cách có hiệu quả đến các tế bào con và thế hệ động vật con. Một nghiên cứu được tiến hành cách đây vài năm cho thấy rằng vector chứa một hỗn hợp các khởi điểm tái bản động vật trong một plasmid có hiệu quả cao đối với việc tạo chuột chuyển gen. Vector này có thể được truyền từ chuột sang vi khuẩn, từ vi khuẩn sang phôi lợn và từ phôi lợn quay trở lại vi khuẩn (Attal, 1997). Tuy nhiên vector này không ổn định khi xen một gen vào trong nó. Hơn nữa nó không được duy trì trong suốt đời sống của chuột và không được truyền lại cho thế hệ con. Vì vậy vector này chứa một khởi điểm tái bản có hiệu quả đối với sự truyền lại có tính chất thống kê trong quá trình phân chia tế bào nhanh nhưng không có hiệu quả trong quá trình phân chia tế bào chậm. Điều này được giải thích là do vector này không mang bất kỳ yếu tố nào đóng vai trò của tâm động.
Nhiễm sắc thể eukaryote chứa các trình tự lặp lại ở phần trung tâm của chúng. Các trình tự lặp lại này bám vào bộ khung tế bào (cytoskeleton) trong suốt quá trình nguyên phân, cho phép các nhiễm sắc thể được phân chia về các tế bào con với phương thức thích hợp. Vùng tâm động đã được thêm vào một vài vector episome. Các đoạn tâm động rất dài tất nhiên được sử dụng và chúng mang tính đặc hiệu loài. Vì vậy không thể sử dụng chúng để thiết kế các vector ngắn.
Một số virus có genome dạng vòng tái bản với tần số cao trong tế bào động vật và vì vậy được truyền lại cho các tế bào con có tính chất thống kê. Đây là trường hợp của virus SV40.
Khởi điểm tái bản của virus SV40 đã được nghiên cứu kỹ. Khởi điểm này có kích thước ngắn nhưng cần có kháng nguyên T mã hoá bởi genome SV40 và các thành phần tế bào Linh trưởng để tái bản. Vector SV40 chuyển vào tế bào tổng hợp kháng nguyên T (tế bào Cos) được sử dụng phổ biến để biểu hiện gen ngoại lai với tần số cao. Vector này không tái bản trong các tế bào không thuộc bộ Linh trưởng và vì vậy không thể sử dụng để tạo động vật chuyển gen.
Virus herpes ở trạng thái tiềm sinh trong các tế bào nhiễm. Mỗi tế bào chứa một hoặc vài bản sao genome virus mà các bản sao này được truyền cho các tế bào con. Trong những trường hợp nhất định và đặc biệt khi cơ thể bị nhiễm suy giảm miễn dịch, genome virus tái bản với tần số cao gây ra trạng thái bệnh lý có liên quan. Đây là trường hợp đối với virus Herpes simplex, cytomegalovirus, virus Epstein-Barr và một số virus khác.
Các virus này có khởi điểm tái bản và một hệ thống tâm động giả (pseudocentromeric system). Hai yếu tố này đã được nghiên cứu một cách chi tiết ở virus Epstein-Barr (EBV). Các vùng có kích thước nhỏ nhất cần thiết cho sự tái bản của genome EBV và sự di truyền của chúng cho các tế bào con là vùng khởi điểm tái bản P (ori P) và gen EBNA 1 (Epstein-Barr nuclear antigen). Vùng khởi điểm tái bản P chứa hai vùng có chức năng riêng biệt. Cả hai đều bám vào protein EBNA 1. Một vùng của khởi điểm tái bản P làm đúng chức năng khởi điểm tái bản. Vùng thứ hai là cần cho sự truyền genome của virus cho các tế bào con.
Các kết quả nghiên cứu đã cho thấy rằng khởi điểm tái bản của EBV chỉ hoạt động ở tế bào Linh trưởng và chó. Khởi điểm tái bản EBV có thể bị mất và được thay thế bằng các đoạn DNA genome người hoặc các động vật có vú khác. Một số các đoạn DNA genome này chứa một khởi điểm tái bản cho phép vector tái bản và truyền lại cho các tế bào con ngay cả ở chuột chuyển gen (Kelleher, 1998). Tuy nhiên vẫn chưa có bằng chứng chứng minh rằng các vector ổn định và đã truyền lại cho thế hệ con.
Trong tất cả các trường hợp, vector EBV phải mang gen EBNA 1 và vùng khởi điểm tái bản P để cho protein EBNA 1 này bám vào. Hệ thống EBV EBNA 1-ori P không mang tính đặc hiệu loài. Các vector chứa phức hợp EBNA 1-ori P bám không đặc hiệu vào chromatin trong các tế bào eukaryote khác nhau. Một nghiên cứu mới đây cho thấy rằng EBNA 1 bám vào ori P và protein EBP 2 nhận ra các thành phần chưa biết được ở chromatin (Hình 1.15 ). Một vector vòng mang vùng ori P bám vào EBNA 1 và một khởi điểm tái bản nấm men đã được duy trì hoàn toàn hiệu quả ở nấm men biểu hiện cả các gen EBNA 1 và EBP người (Kapoor, Shire và Frappier, 2001). Điều này cho phép đưa ra giả thuyết là vector episome mang một khởi điểm tái bản hoạt động ở tế bào chuột và các gen mã hoá protein EBNA 1 và EBP 2 có thể được duy trì như vector vòng episome trong suốt đời sống của động vật và truyền lại cho thế hệ con. Genome EBV có kích thước 200kb và vector EBV có thể mang đoạn DNA ngoại lai có kích thước trên 100kb.
Vector chứa khởi điểm tái bản SV40 và một trình tự MAR cũng có khả năng duy trì ổn định như các episome trong tế bào nuôi cấy (Jenke, 2002).
Các loại vector này hiện đã được nghiên cứu ở các phòng thí nghiệm là các vector con thoi (shuttle) vì chúng mang cả hệ thống tái bản của prokaryote và eukaryote. Chúng có thể được truyền đến vi khuẩn đường ruột (intestine bacteria) và gieo rắc vào trong môi trường. Điều này có thể tránh được một cách dễ dàng bằng cách loại bỏ khởi điểm tái bản của prokaryote.
Khả năng thiết kế các vector độc lập khác bao gồm sự sử dụng các đoạn DNA genome dài chứa các khởi điểm tái bản tự nhiên, một tâm động và các telomere. Các vector này là các nhiễm sắc thể nhân tạo của người (HAC), chỉ có thể có được sau khi xảy ra các đột biến ngẫu nhiên loại bỏ đi một phần lớn nhiễm sắc thể nhưng giữ lại các yếu tố nhỏ nhất để tạo ra một hệ thống tự chủ (Vos, 1998; Voet, 2001). Thao tác đối với vector này không dễ dàng và rất khó để đưa gen ngoại lai vào trong chúng. Hơn nữa, các đoạn genome dài này chứa nhiều gen có thể can thiệp vào sinh lý học động vật hoặc can thiệp vào gen quan tâm khi nó được thêm vào vector.
Nhiễm sắc thể chuột có kích thước 60Mb bao gồm DNA vệ tinh quanh thể trung tâm của chuột đã được tạo ra trong một dòng tế bào lai động vật gậm nhấm/người. Cấu trúc này đã được duy trì trong một thời gian dài trong tế bào nuôi cấy, ở chuột chuyển gen và đã truyền lại cho thế hệ sau (Co, 2000).
 |
| Cấu trúc của vector episome vòng dựa trên genome virus Epstein-Barr (EBV) |
Protein EBNA 1 được mã hoá bởi genome EBV bám vào một vùng khác của genome EBV. Protein EBNA 1 bám vào một protein của tế bào là EBP 2. Protein EBP 2 liên kết với các yếu tố không đặc hiệu của chromatin. Hệ thống giống như tâm động này cho phép truyền vector cho các tế bào con. Khởi điểm tái bản của EBV hoạt động hầu như riêng biệt trong các tế bào Linh trưởng.
Một nghiên cứu cách đây vài năm cho thấy rằng nhiễm sắc thể số 2 của người có thể được chuyển vào genome chuột. Nó đã tồn tại và truyền lại cho thế hệ sau. Nhiễm sắc thể số 2 của người đã được chuyển từ nguyên bào sợi người đến tế bào gốc phôi chuột bằng dung hợp tế bào. Các tế bào gốc phôi mang nhiễm sắc thể người được sử dụng để tạo chuột chuyển gen thể khảm. Chuột chuyển gen thể khảm này đã biểu hiện gen globulin miễn dịch (immunoglobulin) nằm trên nhiễm sắc thể số 2. Vì vậy có thể thu được các kháng thể đơn dòng người từ những con chuột này (Tomizuka, 1997).
Vector episome sẽ hoàn toàn hữu dụng cho các nhà nghiên cứu, cho việc nghiên cứu gen trong các tế bào bị nhiễm cũng như đối với liệu pháp gen và việc tạo động vật chuyển gen.
Vector thay thế gen
Một tái tổ hợp tương đồng giữa hai đoạn DNA có thể xảy ra trong các cơ thể khác nhau nếu chúng mang một trình tự DNA chung. Ở vi khuẩn kích thước cần thiết của đoạn DNA này là một vài trăm bp, ở nấm men tối thiểu là 20-50bp và ở tế bào động vật là vài ngàn bp để gây nên tái tổ hợp tương đồng. Cơ sở của cơ chế tái tổ hợp tương đồng được mô tả ở hình 1.16. Nếu một trình tự tương đồng đơn có mặt trong genome và DNA ngoại sinh thì sự tái tổ hợp dẫn đến sự hợp nhất đích (targeted intergration) của DNA ngoại lai (Hình 1.17). Nếu hai trình tự tương đồng khác biệt hiện diện trong DNA ngoại sinh thì hai tái tổ hợp tương đồng xảy ra một cách độc lập dẫn đến sự thay thế riêng biệt một vùng genome (Hình 1.16). Vì vậy một trình tự ngoại lai có thể được hợp nhất một cách chính xác vào vị trí đã cho của genome. Trình tự ngoại lai này có thể làm ngắt quãng gen đích, làm cho nó trở nên bất hoạt. Protocol này được gọi là knock-out gen. Trình tự ngoại lai có thể là một gen hoạt động có thể liên quan hoặc không liên quan với gen đích. Sự hợp nhất này được gọi là knock-in gen.
Vector sắp xếp lại các gen đích
Tái tổ hợp tương đồng trong một genome là sự kiện sinh lý quan trọng xảy ra trong các trường hợp khác nhau. Sự sắp xếp lại genome tạo ra các gen globulin miễn dịch hoạt động chức năng là một ví dụ. Thật là quan trọng để sắp xếp lại genome ở các vị trí mà không thể tiến hành một cách tự nhiên với một phương thức kiểm soát.
 |
| Sự chọn lọc dương tính và âm tính kép để tách chiết tế bào mà tái tổ hợp tương đồng xảy ra |
A. Tái tổ hợp tương đồng bao hàm sự hợp nhất của gen neor và loại đi gen TK. Các tế bào này là kháng với G418 và gancyclovir.
B. Sau sự hợp nhất của vector vào một vị trí ngẫu nhiên, các tế bào kháng với G418 nhưng nhạy cảm với gancyclovir
Hai hệ thống không phát hiện thấy trong giới động vật đã được bổ sung để thực hiện điều này. Một hệ thống có nguồn gốc từ bacteriophage P1. Genome này chứa các trình tự LoxP với kích thước 34 bp, có khả năng tái kết hợp và mang tính đặc hiệu cao chỉ khi có mặt enzyme recombinase của phage Cre. Hệ thống thứ hai là tương tự một cách cơ bản nhưng có nguồn gốc khởi đầu từ nấm men. Trình tự FRT tái kết hợp với hiệu quả cao và mang tính đặc hiệu khi có mặt enzyme recombinase Flp. Hệ thống Cre-LoxP là phổ biến nhất và được sử dụng trong nhiều nghiên cứu khác nhau (Nagy, 2000). Các thể đột biến khác nhau của các trình tự LoxP, FRT đang được sử dụng để điều chỉnh hiệu quả và tính đặc hiệu của sự tái tổ hợp. Hai loại enzyme recombinase cũng tồn tại dưới dạng các thể đột biến khác nhau. Trong thực tế, trình tự LoxP hoặc FRT phải được thêm vào cấu trúc của gen.
 |
Ưu điểm chính của các hệ thống LoxP và FRT là sự tái tổ hợp chỉ xảy ra khi có mặt recombinase. Các tế bào hoặc động vật có vùng DNA tiếp giáp với các trình tự LoxP thì không có recombinase. Các enzyme này có thể được bổ sung vào trong tế bào in vitro hoặc in vivo ở động vật chuyển gen bằng cách vi tiêm trực tiếp vào tế bào chất hoặc bằng phương pháp chuyển nhiễm (transfection method) đối với protein. Gen recombinase có thể được đưa vào tế bào bằng vector adenovirus. Các vector này được tiêm vào mô của động vật chuyển gen mang vùng DNA tiếp giáp với các trình tự LoxP. Hơn nữa, plasmid chứa các gen recombinase cũng có thể được đưa vào phôi giai đoạn một tế bào hoặc vào các tế bào soma. Các plasmid này có ít cơ hội hợp nhất do cấu trúc dạng vòng của chúng. Chúng biến mất nhanh chóng trong quá trình nhân tế bào và sự có mặt của recombinase là nhất thời.
Các recombinase cũng có thể được truyền cho động vật chuyển gen bằng sự chuyển gen. Chuột chuyển gen mang gen recombinase có thể được lai với các dòng chứa vùng DNA tiếp giáp với trình tự LoxP.
Một cách lý tưởng, các gen recombinase không nên biểu hiện ở nhiều trường hợp trong tất cả các mô hoặc biểu hiện thường xuyên. Nếu điều này là cần thiết thì recombinase có thể được đặt dưới sự kiểm soát của các promoter hoạt động trong tất cả các loại tế bào. Trái ngược lại, các promoter đặc hiệu đối với từng mô có thể hạn chế sự tái tổ hợp LoxP trong tế bào mà các promoter này hoạt động. Hệ thống biểu hiện này đã kiểm soát bởi tetrecycline và các dẫn xuất của tetracycline, cho phép gen recombinase chỉ được biểu hiện trong một loại tế bào và chỉ khi động vật có tetracycline.
Một bước điều hoà khác có thể thêm vào để kiểm soát recombinase Cre. Các gen dung hợp mang trình tự mã hoá recombinase Cre và một phần các thụ quan steroid đã được xây dựng. Protein dung hợp này chỉ hoạt động khi có mặt steroid và steroid đã gây ra sự biến đổi hình thể của protein.
Trình tự NLS (nuclear localization signal = tín hiệu định vị nhân) cho phép recombinase tập trung ở nhân và đạt hiệu quả ngay cả khi ở nồng độ thấp. Trường hợp này có thể xảy ra phụ thuộc vào tính đặc hiệu tế bào nhưng các promoter yếu đang được sử dụng để biểu hiện các gen recombinase.
Tất cả các hệ thống tinh vi này nhằm gây ra sự tái tổ hợp có thể càng chính xác để giống hệt như sự biểu hiện các gen tự nhiên hoặc để tạo ra các điều kiện thí nghiệm thích hợp nhất.
Điều quan trọng là tránh sự biểu hiện cao của gen ricombinase. Các enyzme này bộc lộ một vài độc tính đối với tế bào ở nồng độ cao, còn hầu như là thích hợp nhờ khả năng nhận biết các vị trí giống như LoxP hoặc FRT trong genome động vật.
Nguồn tham khảo:
https://voer.edu.vn/m/cac-vector-su-dung-de-chuyen-gen-o-dong-vat/133e113f







Không có nhận xét nào:
Đăng nhận xét